Biología molecular del melanoma
Molecular biology of melanoma
Cómo citar
Descargar cita

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Mostrar biografía de los autores
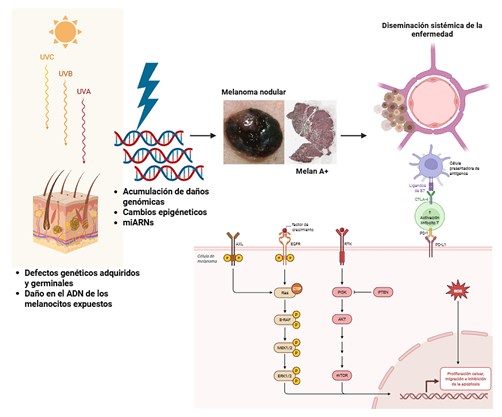
Introducción: El melanoma es una neoplasia agresiva con incidencia creciente en Colombia. Datos recientes evidencian diferencias relevantes en la distribución de sus subtipos en comparación con poblaciones internacionales, con una mayor frecuencia de melanoma lentiginoso acral y lentigo maligno, lo que sugiere la influencia de factores genéticos, ambientales o demográficos propios de la población colombiana.
Objetivo: Describir las alteraciones moleculares relacionadas con la patogénesis del melanoma cutáneo, el sistema de clasificación molecular vigente, incluyendo comutaciones relevantes, así como los mecanismos fisiopatológicos que fundamentan el uso de las alternativas terapéuticas actualmente empleadas en esta entidad.
Métodos: Se realizó una revisión de la literatura en bases de datos como PubMed, Embase, Scopus, Web of Science y Google Scholar. Se incluyeron artículos relacionados con los mecanismos fisiopatológicos que sustentan los sistemas actuales de clasificación molecular del melanoma, las mutaciones más frecuentemente documentadas en melanoma cutáneo en humanos y los predictores de respuesta a tratamientos dirigidos.
Resultados: Se seleccionaron 29 artículos que describen las principales alteraciones moleculares del melanoma cutáneo, incluyendo mutaciones en genes implicados en la regulación genómica y la respuesta metabólica. Se presenta una síntesis narrativa de las alteraciones que sustentan la oncogénesis, la progresión tumoral y los mecanismos de resistencia terapéutica.
Conclusiones: El melanoma cutáneo en Colombia presenta particularidades clínicas y epidemiológicas que lo diferencian del comportamiento global, con predominio del subtipo lentiginoso acral. Aunque la clasificación histológica proporciona una aproximación inicial a la heterogeneidad de la enfermedad, la diversidad de mutaciones canónicas y no canónicas, así como su impacto en el comportamiento clínico y la respuesta terapéutica, permite una caracterización más precisa de su complejidad.
Visitas del artículo 0 | Visitas PDF 0
Descargas
- Rashid S, Shaughnessy M, Tsao H. Melanoma classification and management in the era of molecular medicine. Dermatol Clin. [internet] 2023;41(1):49–63. Disponible en: https://doi.org/10.1016/j.det.2022.07.017
- Uribe Ortiz PA, Nova Villanueva JA, Colmenares Mejia CC, Palma Escobar L, Gil Quiñones SR. Características del melanoma cutáneo en dos instituciones de Bogotá, Colombia: análisis 2012–2016. Rev Colomb Cancerol. [internet] 2021;25(4):188–195. Disponible en: https://doi.org/10.35509/01239015.692
- Ospina Serrano AV, Contreras F, Triana I, Sánchez-Vanegas GS, Ortiz JD, Ramos P, et al. Clinical outcomes and prognostic factors of patients with early malignant melanoma in one Latin American country: results of the Epidemiological Registry of Malignant Melanoma in Colombia Study. JCO Glob Oncol. [internet] 2023;9:e2200377. Disponible en: https://doi.org/10.1200/GO.22.00377
- Mirek J, Bal W, Olbryt M. Melanoma genomics – will we go beyond BRAF in clinics? J Cancer Res Clin Oncol. [internet] 2024;150:433. Disponible en: https://doi.org/10.1007/s00432-024-05957-2
- The Cancer Genome Atlas Network. Genomic classification of cutaneous melanoma. Cell. [internet] 2015;161(7):1681–1696. Disponible en: https://doi.org/10.1016/j.cell.2015.05.044
- Phadke MS, Smalley KSM. Targeting NRAS mutations in advanced melanoma. J Clin Oncol. [internet] 2023;41(14:2661-2664. Disponible en: https://doi.org/10.1200/JCO.23.00205
- Li C, Kuai L, Cui R, Miao X. Melanogenesis and the targeted therapy of melanoma. Biomolecules. [internet] 2022;12(12):1874. Disponible en: https://doi.org/10.3390/biom12121874
- Castellani G, Buccarelli M, Arasi MB, Rossi S, Pisanu ME, Bellenghi M, et al. BRAF mutations in melanoma: biological aspects, therapeutic implications, and circulating biomarkers. Cancers (Basel). [internet] 2023;15(16):4026. Disponible en: https://doi.org/10.3390/cancers15164026
- Menzer C, Menzies AM, Carlino MS, Reijers I, Groen EJ, Eigentler T, et al. Targeted therapy in advanced melanoma with rare BRAF mutations. J Clin Oncol. [internet] 2019;37(33):3142-3151. Disponible en: https://doi.org/10.1200/jco.19.00489
- Gouda MA, Subbiah V. Precision oncology for BRAF-mutant cancers with BRAF and MEK inhibitors: from melanoma to tissue-agnostic therapy. ESMO Open. [internet] 2023;8(2):100788. Disponible en: https://doi.org/10.1016/j.esmoop.2023.100788
- Luebker SA, Koepsell SA. Diverse mechanisms of BRAF inhibitor resistance in melanoma identified in clinical and preclinical studies. Front Oncol. [internet] 2019;9:268. Disponible en: https://doi.org/10.3389/fonc.2019.00268
- Al Mahi A, Ablain J. RAS pathway regulation in melanoma. Dis Model Mech. [internet] 2022;15(2):dmm049229. Disponible en: https://doi.org/10.1242/dmm.049229
- Báez-Flores J, Rodríguez-Martín M, Lacal J. The therapeutic potential of neurofibromin signaling pathways and binding partners. Commun Biol. [internet] 2023;6(1):436. Disponible en: https://doi.org/10.1038/s42003-023-04815-0
- Ferrara G, Argenziano G. The WHO 2018 classification of cutaneous melanocytic neoplasms: suggestions from routine practice. Front Oncol. [internet] 2021;11:675296. Disponible en: https://doi.org/10.3389/fonc.2021.675296
- Wang L, Kim KB, Kashani-Sabet M, Dighe PR, Aboosaiedi A. Outcomes of patients with advanced NF1-mutant melanoma treated with MEK inhibitors. [Abstract]w Target Oncol. [internet] 2023;41(16suppl):e21513. Disponible en: https://doi.org/10.1200/jco.2023.41.16_suppl.e21513
- Huang AC, Zappasodi R. A decade of checkpoint blockade immunotherapy in melanoma: understanding the molecular basis for immune sensitivity and resistance. Nat Immunol. [internet] 2022;23(5):660–670. Disponible en: https://doi.org/10.1038/s41590-022-01141-1
- Olbryt M, Rajczykowski M, Widłak W. Biological factors behind melanoma response to immune checkpoint inhibitors. Int J Mol Sci. [internet] 2020;21(11):4071. Disponible en: https://doi.org/10.3390/ijms21114071
- Gandara DR, Agarwal N, Gupta S, Klempner SJ, Andrews MC, Mahipal A, et al. Tumor mutational burden and survival on immune checkpoint inhibition in >8000 patients across 24 cancer types. J Immunother Cancer. [internet] 2025;13(2):e010311. Disponible en: https://doi.org/10.1136/jitc-2024-010311corr1
- Andrews MC, Li G, Graf RP, Fisher VA, Mitchell J, Aboosaiedi A, et al. Predictive impact of tumor mutational burden on real-world outcomes of first-line immune checkpoint inhibition in metastatic melanoma. JCO Precis Oncol. [internet] 2024;8:e2300640. Disponible en: https://doi.org/10.1200/po.23.00640
- Zielińska MK, Ciążyńska M, Sulejczak D, Rutkowski P, Czarnecka AM. Mechanisms of resistance to anti-PD-1 immunotherapy in melanoma and strategies to overcome it. Biomolecules. [internet] 2025;15(2):269. Disponible en: https://doi.org/10.3390/biom15020269
- Zhao X, Ma Y, Luo J, Xu K, Tian P, Lu C, et al. Blocking the WNT/β-catenin pathway in cancer treatment: pharmacological targets and drug therapeutic potential. Heliyon. [internet] 2024;10(16),e35989. Disponible en: https://doi.org/10.1016/j.heliyon.2024.e35989
- Reinfeld BI, Rathmell WK, Kim TK, Rathmell JC. The therapeutic implications of immunosuppressive tumor aerobic glycolysis. Cell Mol Immunol. [internet] 2022;19(1):46–58. Disponible en: https://doi.org/10.1038/s41423-021-00727-3
- Liu ZL, Chen HH, Zheng LL, Sun LP, Shi L. Angiogenic signaling pathways and anti-angiogenic therapy for cancer. Signal Transduct Target Ther. [internet] 2023;8(1):198. Disponible en: https://doi.org/10.1038/s41392-023-01460-1
- Baradaran A, Asadzadeh Z, Hemmat N, Baghbanzadeh A, Shadbad MA, Khosravi N, et al. The cross-talk between tumor-associated macrophages and tumor endothelium: recent advances in macrophage-based cancer immunotherapy. Biomed Pharmacother. [internet] 2022;146:112588. Disponible en: https://doi.org/10.1016/j.biopha.2021.112588
- Wu Z, Bian Y, Chu T, Wang Y, Man S, Song Y, et al. The role of angiogenesis in melanoma: clinical treatments and future expectations. Front Pharmacol. [internet] 2022;13:1028647. Disponible en: https://doi.org/10.3389/fphar.2022.1028647
- Wang Z, Li J, Guo J, Wei P. Direct antitumor activity of bevacizumab: an overlooked mechanism? Front Pharmacol. [internet] 2024;15:1394878. Disponible en: https://doi.org/10.3389/fphar.2024.1394878
- Han X, Ge P, Liu S, Yang D, Zhang J, Wang X, et al. Efficacy and safety of bevacizumab in patients with malignant melanoma: a systematic review and PRISMA-compliant meta-analysis of randomized controlled trials and non-comparative clinical studies. Front Pharmacol. [internet] 2023;14:1163805. Disponible en: https://doi.org/10.3389/fphar.2023.1163805
- Capozzi M, De Divitiis C, Ottaiano A. Lenvatinib, a molecule with versatile application: from preclinical evidence to future development in anti-cancer treatment. Cancer Manag Res. [internet] 2019;11:3847–3860. Disponible en: https://doi.org/10.2147/cmar.s188316
- Arance A, De la Cruz-Merino L, Petrella TM, Jamal R, Ny L, Carneiro A, et al. Phase II LEAP-004 study of lenvatinib plus pembrolizumab for melanoma with confirmed progression on PD-1 or PD-L1 inhibitors. J Clin Oncol. [internet] 2022;41(1):75-85. Disponible en: https://doi.org/10.1200/JCO.22.00221