Aplicaciones de la genómica en el diseño e implementación de ensayos clínicos oncológicos: hacia una nueva era en la investigación clínica
Applications of genomics in the design and implementation of cancer clinical trials: towards a new era in clinical research
Cómo citar
Descargar cita

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Mostrar biografía de los autores
Introducción: la genómica ha transformado la investigación clínica oncológica al permitir una caracterización molecular detallada de los tumores. Esto ha impulsado el desarrollo de ensayos clínicos más precisos, diseñados para evaluar tratamientos dirigidos a subgrupos moleculares específicos y que superan las limitaciones de los enfoques tradicionales centrados en el órgano de origen.
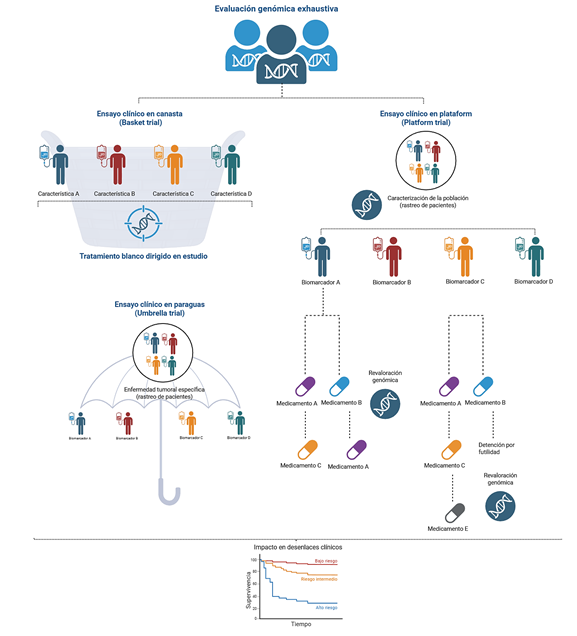
Métodos: se realizó una revisión narrativa de la literatura científica publicada entre 2008 y 2024, enfocada en artículos originales, revisiones sistemáticas y guías clínicas que abordan el uso de la genómica en el diseño, la ejecución y la interpretación de ensayos clínicos. Se priorizaron estudios sobre cáncer sólido y hematológico, así como ejemplos de diseños tipo basket, umbrella y adaptativos.
Resultados: la incorporación de biomarcadores genómicos ha dado lugar a nuevos modelos de diseño, como los ensayos tumoragnósticos, que permiten seleccionar pacientes con base en alteraciones moleculares más allá del tipo histológico. Ensayos como NCI-MATCH, SHIVA, TAPUR e I-SPY2 demuestran que este enfoque mejora la tasa de respuesta y acelera el desarrollo de terapias dirigidas. No obstante, persisten desafíos relacionados con la validación de biomarcadores, el manejo de datos genómicos, la equidad en el acceso a las pruebas moleculares y la interpretación clínica de las variantes.
Conclusión: el uso de la genómica en los ensayos clínicos constituye una herramienta clave para avanzar hacia una oncología personalizada. La adopción de diseños innovadores requiere esfuerzos colaborativos que integren tecnología, bioinformática, regulación y ética para garantizar una aplicación efectiva y equitativa en la investigación clínica.
Visitas del artículo 0 | Visitas PDF 0
Descargas
- Simon R. The Use of Genomics in Clinical Trial Design. Clinical Cancer Research [Internet]. 2008;14:5984–93. Disponible en: https://doi.org/10.1158/1078-0432.ccr-07-4531
- Roychowdhury S. Cancer Genomics Meets Clinical Trials: The Challenge ahead. Personalized Medicine [Internet]. 2012;9:459–61. Disponible en: https://doi.org/10.2217/pme.12.50
- Marabelle A, Fakih M, Lopez J, Shah M, Shapira-Frommer R, Nakagawa K, et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. The Lancet Oncology [Internet]. 2020;21:1353–65. Disponible en: https://doi.org/10.1016/s1470-2045(20)30445-9
- Drilon A, Laetsch TW, Kummar S, DuBois SG, Lassen UN, Demetri GD, et al. Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. N Engl J Med [Internet]. 2018;378:731–9. Disponible en: https://doi.org/10.1056/nejmoa1714448
- Doebele RC, Drilon A, Paz-Ares L, Siena S, Shaw AT, Farago AF, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1–2 trials. The Lancet Oncology [Internet]. 2020;21(2):271–82. Disponible en: https://doi.org/10.1016/S1470-2045(19)30691-6
- Farhangfar CJ, Scarola GT, Morris VA, Farhangfar F, Dumas K, Symanowski J, et al. Impact of a Clinical Genomics Program on Trial Accrual for Targeted Treatments: Practical Approach Overcoming Barriers to Accrual for Underserved Patients. JCO Clinical Cancer Informatics [Internet]. 2022:e2200011. Disponible en: https://doi.org/10.1200/cci.22.00011
- Fountzilas E, Tsimberidou AM, Vo HH, Kurzrock R. Clinical trial design in the era of precision medicine. Genome Med [Internet]. 2022;14:101. Disponible en: https://doi.org/10.1186/s13073-022-01102-1
- Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, et al. Intratumor Heterogeneity and Branched Evolution Revealed by Multiregion Sequencing. N Engl J Med [Internet]. 2012;366:883–92. Disponible en: https://doi.org/10.1056/nejmoa1113205
- Fontes Jardim DL, Schwaederle M, Wei C, Lee JJ, Hong DS, Eggermont AM, et al. Impact of a Biomarker-Based Strategy on Oncology Drug Development: A Meta-analysis of Clinical Trials Leading to FDA Approval. JNCIJ [Internet]. 2015;107:djv253. Disponible en: https://doi.org/10.1093/jnci/djv253
- Schwaederle M, Zhao M, Lee JJ, Eggermont AM, Schilsky RL, Mendelsohn J, et al. Impact of Precision Medicine in Diverse Cancers: A Meta-Analysis of Phase II Clinical Trials. JCO [Internet]. 2015;33(32):3817–25. Disponible en: https://doi.org/10.1200/jco.2015.61.5997
- Asad S, Kananen K, Mueller KR, Symmans WF, Wen Y, Perou CM, et al. Challenges and Gaps in Clinical Trial Genomic Data Management. JCO Clinical Cancer Informatics [Internet]. 2022;e2100193. Disponible en: https://doi.org/10.1200/cci.21.00193
- Enoma D. Genomics in Clinical trials for Breast Cancer. Briefings in Functional Genomics [Internet]. 2024;23:325–34. Disponible en: https://doi.org/10.1093/bfgp/elad054
- Simon R, Roychowdhury S. Implementing personalized cancer genomics in clinical trials. Nat Rev Drug Discov [Internet]. 2013;12:358–69. Disponible en: https://doi.org/10.1038/nrd3979
- Bhatt DL, Mehta C. Adaptive Designs for Clinical Trials. Drazen JM, Harrington DP, McMurray JJV, Ware JH, Woodcock J, editores. N Engl J Med [Internet]. 2016;375:65–74. Disponible en: https://doi.org/10.1056/nejmra1510061
- American Society of Clinical Oncology. Targeted Agent and Profiling Utilization Registry (TAPUR) Study [Internet]. clinicaltrials.gov; 2025. Report No.: NCT02693535. Disponible en: https://doi.org/10.1200/adn.19.190373
- Ferrarotto R, Redman MW, Gandara DR, Herbst RS, Papadimitrakopoulou VA. Lung-MAP—framework, overview, and design principles. Chinese Clinical Oncology [Internet]. 2015;4(3):36. Disponible en: https://doi.org/10.3978/j.issn.2304-3865.2015.09.02
- Barker A, Sigman C, Kelloff G, Hylton N, Berry D, Esserman L. I-SPY 2: An Adaptive Breast Cancer Trial Design in the Setting of Neoadjuvant Chemotherapy. Clin Pharmacol Ther [Internet]. 2009;86(1):97–100. Disponible en: https://doi.org/10.1038/clpt.2009.68
- ECOG-ACRIN Cancer Research Group. EAY131 / NCI-MATCH (Closed) [Internet]. Disponible en: https://ecog-acrin.org/clinical-trials/eay131-nci-match-precision-medicine/
- Azad NS, Gray RJ, Overman MJ, Schoenfeld JD, Mitchell EP, Zwiebel JA, et al. Nivolumab Is Effective in Mismatch Repair–Deficient Noncolorectal Cancers: Results From Arm Z1D—A Subprotocol of the NCI-MATCH (EAY131) Study. JCO [Internet]. 2020;38:214–22. Disponible en: https://doi.org/10.1200/jco.19.00818
- Le Tourneau C, Delord JP, Gonçalves A, Gavoille C, Dubot C, Isambert N, et al. Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer (SHIVA): a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. The Lancet Oncology [Internet]. 2015;16:1324–34. Disponible en: https://doi.org/10.1016/s1470-2045(15)00188-6
- Alva AS, Mangat PK, Garrett-Mayer E, Halabi S, Hansra D, Calfa CJ, et al. Pembrolizumab in Patients With Metastatic Breast Cancer With High Tumor Mutational Burden: Results From the Targeted Agent and Profiling Utilization Registry (TAPUR) Study. JCO [Internet]. 2021;39:2443–51. Disponible en: https://doi.org/10.1200/jco.20.02923
- Nanda R, Liu MC, Yau C, Shatsky R, Pusztai L, Wallace A, et al. Effect of Pembrolizumab Plus Neoadjuvant Chemotherapy on Pathologic Complete Response in Women With Early-Stage Breast Cancer: An Analysis of the Ongoing Phase 2 Adaptively Randomized I-SPY2 Trial. JAMA Oncol [Internet]. 2020;6:676. Disponible en: https://doi.org/10.1001/jamaoncol.2019.6650
- Gettinger SN, Redman MW, Bazhenova L, Hirsch FR, Mack PC, Schwartz LH, et al. Nivolumab Plus Ipilimumab vs Nivolumab for Previously Treated Patients With Stage IV Squamous Cell Lung Cancer: The Lung-MAP S1400I Phase 3 Randomized Clinical Trial. JAMA Oncol [Internet]. 2021;7(9):1368-1377. Disponible en: https://doi.org/10.1001/jamaoncol.2021.2209
- Vasudev NS, Scelo G, Glennon KI, Wilson M, Letourneau L, Eveleigh R, et al. Application of Genomic Sequencing to Refine Patient Stratification for Adjuvant Therapy in Renal Cell Carcinoma. Clinical Cancer Research [Internet]. 2023;29:1220–31. Disponible en: https://doi.org/10.1158/1078-0432.ccr-22-1936
- Nangalia J, Campbell PJ. Genome Sequencing during a Patient’s Journey through Cancer. N Engl J Med [Internet]. 2019;381:2145–56. Disponible en: https://doi.org/10.1056/nejmra1910138
- Winkler EC, Knoppers BM. Ethical challenges of precision cancer medicine. Seminars in Cancer Biology [Internet]. 2022;84:263–70. Disponible en: https://doi.org/10.1016/j.semcancer.2020.09.009
- Klein RD. Current Policy Challenges in Genomic Medicine. Clinical Chemistry [Internet]. 2020;66:61–7. Disponible en: https://doi.org/10.1373/clinchem.2019.308775

















