Ancestría genética y cáncer en América Latina: evidencia emergente y retos hacia la medicina de precisión
Genetic ancestry and cancer in Latin America: emergent evidence and challenges for precision medicine
Cómo citar
Descargar cita

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Mostrar biografía de los autores
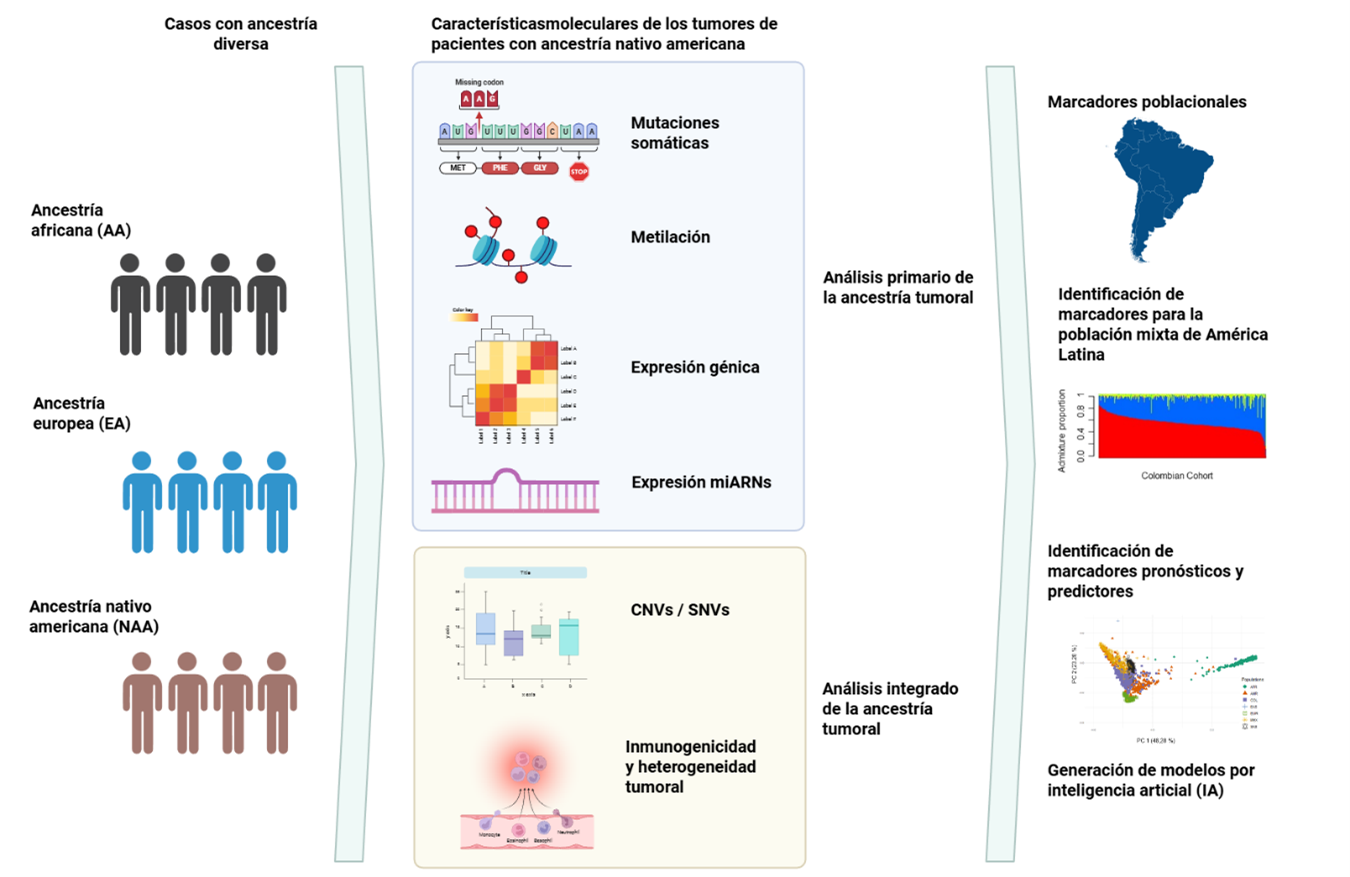
Introducción: América Latina constituye un mosaico genético trihíbrido, con ~50–60% de ancestría europea, ~30–40% indígena americana (IA) y ~10% africana, además de aportes regionales de ancestría asiática (p. ej., Perú). Estas fracciones modulan la biología tumoral y la expresión de biomarcadores.
Métodos: se realizó una revisión exhaustiva de la literatura sobre ancestría genética y cáncer en América Latina. Se incluyeron estudios de genética poblacional, GWAS, mapeo de mestizaje, perfiles somáticos y análisis multiómicos. La evidencia se organizó por tipo de cáncer y componente ancestral, considerando su relevancia clínica y traslacional.
Resultados: en cáncer de mama, cada incremento de +10% de ancestría IA se asocia con una reducción aproximada del 15–20% del riesgo, atribuida parcialmente a un haplotipo protector de IA en 6q25/ESR1; sin embargo, varias cohortes reportan mayor frecuencia de subtipos agresivos (HER2/TNBC) con mayor IA. En cáncer de próstata, +10% de IA reduce el riesgo en ~16%, y las puntuaciones de riesgo poligénico (PRS) son útiles si se calibran en poblaciones mestizas. En cáncer de pulmón, una mayor IA se asocia con mutaciones frecuentes en EGFR y firmas mutacionales distintivas. Otros patrones incluyen riesgo de vesícula en mapuches y diferencias ancestría dependientes en cáncer colorrectal y hepatocelular.
Discusión: la regulación génica y los perfiles somáticos respaldan estas asociaciones, con aplicabilidad limitada por la subrepresentación latinoamericana.
Conclusión: integrar sistemáticamente la ancestría genética en la epidemiología, los biomarcadores y los ensayos clínicos es esencial para avanzar hacia una oncología de precisión equitativa en América Latina.
Visitas del artículo 0 | Visitas PDF 0
Descargas
- Zambrano-O YT, Mejía-Garcia A, Morales PD, Tsao HM, Rey-Vargas L, Montero-Ovalle W, et al. Inference of genetic ancestry from a multi-gene cancer panel in Colombian women with cancer. Breast Cancer Res Treat. [Internet] 2025;210(2):251-259. Disponible en: https://doi.org/ 10.1007/s10549-024-07557-7.
- Matejcic M, Teer JK, Hoehn HJ, Diaz DB, Shankar K, Gong J, et al. Colorectal Tumors in Diverse Patient Populations Feature a Spectrum of Somatic Mutational Profiles. Cancer Res [Internet] 2025;85(10):1928-1944. Disponible en: https://doi.org/10.1158/0008-5472.CAN-24-0747.
- Fejerman L, Serrano-Gómez SJ, Tamayo LI. Breast Cancer Risk and Mortality in Women of Latin American Origin. 2019. En: Ramirez AG, Trapido EJ (eds). Advancing the Science of Cancer in Latinos. Springer, Cham. [Internet]. Disponible en: https://doi.org/10.1007/978-3-030-29286-7_4
- Homburger JR, Moreno-Estrada A, Gignoux CR, Nelson D, Sanchez E, Ortiz-Tello P, et al. Genomic Insights into the Ancestry and Demographic History of South America. PLoS Genet. [Internet] 2015;11(12):e1005602. Disponible en: https://doi.org/10.1371/journal.pgen.1005602.
- Soares-Souza G, Borda V, Kehdy F, Tarazona-Santos E. Admixture, Genetics and Complex Diseases in Latin Americans and US Hispanics. Curr Genet Med Rep. [Internet] 2018;6(4):208–223. Disponible en: https://doi.org/10.1007/s40142-018-0151-z.
- Borda V, Loesch DP, Guo B, Laboulaye R, Veliz-Otani D, French J, et al.;. Genetics of Latin American Diversity Project: Insights into population genetics and association studies in admixed groups in the Americas. Cell Genom. [Internet] 2024;4(11):100692. Disponible en: https://doi.org/10.1016/j.xgen.2024.100692.
- Fejerman L, John EM, Huntsman S, Beckman K, Choudhry S, Perez-Stable E, et al. Genetic ancestry and risk of breast cancer among U.S. Latinas. Cancer Res. [Internet] 2008;68(23):9723-8. Disponible en: https://doi.org/10.1158/0008-5472.CAN-08-2039.
- Fejerman L, Romieu I, John EM, Lazcano-Ponce E, Huntsman S, Beckman KB, et al. European ancestry is positively associated with breast cancer risk in Mexican women. Cancer Epidemiol Biomarkers Prev. [Internet] 2010;19(4):1074-82. Disponible en: https://doi.org/10.1158/1055-9965.EPI-09-1193.
- Fejerman L, Chen GK, Eng C, Huntsman S, Hu D, Williams A, et al. Admixture mapping identifies a locus on 6q25 associated with breast cancer risk in US Latinas. Hum Mol Genet. [Internet] 2012;21(8):1907-17. Disponible en: https://doi.org/10.1093/hmg/ddr617.
- Norris ET, Wang L, Conley AB, Rishishwar L, Mariño-Ramírez L, Valderrama-Aguirre A, et al. Genetic ancestry, admixture and health determinants in Latin America. BMC Genomics. [Internet] 2018;19(Suppl 8):861. Disponible en: https://doi.org/10.1186/s12864-018-5195-7.
- Serrano-Gomez SJ, Sanabria-Salas MC, Hernández-Suárez G, García O, Silva C, Romero A, et al. High prevalence of luminal B breast cancer intrinsic subtype in Colombian women. Carcinogenesis. [Internet] 2016;37(7):669-676. Disponible en: https://doi.org/10.1093/carcin/bgw043.
- Serrano-Gómez SJ, Sanabria-Salas MC, Garay J, Baddoo MC, Hernández-Suárez G, Mejía JC, et al. Ancestry as a potential modifier of gene expression in breast tumors from Colombian women. PLoS One. [Internet] 2017;12(8):e0183179. Disponible en: https://doi.org/10.1371/journal.pone.0183179.
- Zavala VA, Casavilca-Zambrano S, Navarro-Vásquez J, Castañeda CA, Valencia G, Morante Z, et al. Association between Ancestry-Specific 6q25 Variants and Breast Cancer Subtypes in Peruvian Women. Cancer Epidemiol Biomarkers Prev. [Internet] 2022;31(8):1602-1609. Disponible en: https://doi.org/10.1158/1055-9965.EPI-22-0069.
- Marker KM, Zavala VA, Vidaurre T, Lott PC, Vásquez JN, Casavilca-Zambrano S, et al.; COLUMBUS Consortium. Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer Is Associated with Indigenous American Ancestry in Latin American Women. Cancer Res. [Internet] 2020;80(9):1893-1901. Disponible en: https://doi.org/10.1158/0008-5472.CAN-19-3659.
- Alves da Quinta D, Rocha D, Yáñez C, Binato R, Soares-Lima SC, Huang X, Ganiewich D, et al.; LACRN Investigators; Llera AS, Fejerman L. Genetic Ancestry, Intrinsic Tumor Subtypes, and Breast Cancer Survival in Latin American Women. Cancer Res Commun. [Internet] 2025;5(7):1070-1081. Disponible en: https://doi.org/10.1158/2767-9764.CRC-25-0014.
- Ding YC, Steele L, Warden C, Wilczynski S, Mortimer J, Yuan Y, et al. Molecular subtypes of triple-negative breast cancer in women of different race and ethnicity. Oncotarget. [Internet] 2019;10(2):198-208. Disponible en: https://doi.org/10.18632/oncotarget.26559.
- Du Z, Hopp H, Ingles SA, Huff C, Sheng X, Weaver B, et al. A genome-wide association study of prostate cancer in Latinos. Int J Cancer. [Internet] 2020;146(7):1819-1826. Disponible en: https://doi.org/10.1002/ijc.32525.
- Wang A, Shen J, Rodriguez AA, Saunders EJ, Chen F, Janivara R, et al. Characterizing prostate cancer risk through multi-ancestry genome-wide discovery of 187 novel risk variants. Nat Genet. [Internet] 2023;55(12):2065-2074. Disponible en: https://doi.org/10.1038/s41588-023-01534-4
- Arenas-Gallo C, Rhodes S, Garcia JA, Weinstein I, Prunty M, Lewicki P, et al. Prostate cancer genetic alterations in Hispanic men. Prostate. [Internet] 2023;83(13):1263-1269. Disponible en: https://doi.org/10.1002/pros.24586.
- Carrot-Zhang J, Soca-Chafre G, Patterson N, Thorner AR, Nag A, Watson J, et al. Genetic Ancestry Contributes to Somatic Mutations in Lung Cancers from Admixed Latin American Populations. Cancer Discov. [Internet] 2021;11(3):591-598. Disponible en: https://doi.org/10.1158/2159-8290.CD-20-1165.
- Shi H, Seegobin K, Heng F, Zhou K, Chen R, Qin H, et al. Genomic landscape of lung adenocarcinomas in different races. Front Oncol. [Internet] 2022;12:946625. Disponible en: https://doi.org/10.3389/fonc.2022.946625.
- Rhead B, Pouliot Y, Guinney J, De La Vega FM. Genetic Ancestry and Somatic Mutations in Lung Adenocarcinoma: Insights from Real-World Clinico-Genomic Data. (Preprint). MedRixv. [Internet] 2024. Disponible en: https://doi.org/10.1101/2024.04.24.24306316.
- Lorenzo Bermejo J, Boekstegers F, González Silos R, Marcelain K, Baez Benavides P, Barahona Ponce C, et al. Subtypes of Native American ancestry and leading causes of death: Mapuche ancestry-specific associations with gallbladder cancer risk in Chile. PLoS Genet. [Internet] 2017;13(5):e1006756. Disponible en: https://doi.org/10.1371/journal.pgen.1006756.
- Hernandez-Suarez G, Sanabria MC, Serrano M, Herran OF, Perez J, Plata JL, et al. Genetic ancestry is associated with colorectal adenomas and adenocarcinomas in Latino populations. Eur J Hum Genet. [Internet] 2014;22(10):1208-16. Disponible en: https://doi.org/10.1038/ejhg.2013.310.
- Zollner L, Boekstegers F, Barahona Ponce C, Scherer D, Marcelain K, Gárate-Calderón V, et al. Gallbladder Cancer Risk and Indigenous South American Mapuche Ancestry: Instrumental Variable Analysis Using Ancestry-Informative Markers. Cancers. [Internet] 2023;15(16):4033. Disponible en: https://doi.org/10.3390/cancers15164033.
- Loon E, Narvaez-Barbecho C, Ortiz JP, Balderramo D, Carrera E, Diaz-Ferrer J, et al. Impact of self-reported ancestry on the epidemiology of hepatocellular carcinoma. J Gastroenterol Hepatol. [Internet] 2024;39(6):1201-1202. Disponible en: https://doi.org/10.1111/jgh.16578.
- Das D, Wang X, Chiu YC, Bouamar H, Sharkey FE, Lopera JE, et al. Integrative multi-omics characterization of hepatocellular carcinoma in hispanic patients. J Natl Cancer Inst. [Internet] 2024;116(12):1961-1978. Disponible en: https://doi.org/10.1093/jnci/djae207.
- Ceballos F, Boekstegers F, Scherer D, Barahona Ponce C, Marcelain K, Gárate-Calderón V, et al. Inbreeding and Gallbladder Cancer Risk: Homozygosity Associations Adjusted for Indigenous American Ancestry, BMI, and Genetic Risk of Gallstone Disease. Cancers. [Internet] 2024;16(24):4195. Disponible en: https://doi.org/10.3390/cancers16244195.
- Kachuri L, Mak ACY, Hu D, Eng C, Huntsman S, Elhawary JR, et al. Gene expression in African Americans, Puerto Ricans and Mexican Americans reveals ancestry-specific patterns of genetic architecture. Nat Genet. [Internet] 2023;55(6):952-963. Disponible en: https://doi.org/10.1038/s41588-023-01377-z.
- Carrot-Zhang J, Chambwe N, Damrauer JS, Knijnenburg TA, Robertson AG, Yau C, et al.; Cancer Genome Atlas Analysis Network; Cherniack AD, Beroukhim R. Comprehensive Analysis of Genetic Ancestry and Its Molecular Correlates in Cancer. Cancer Cell. [Internet] 2020;37(5):639-654.e6. Disponible en: https://doi.org/10.1016/j.ccell.2020.04.012.
- Mueller SH, Lai AG, Valkovskaya M, Michailidou K, Bolla MK, Wang Q, et al. Aggregation tests identify new gene associations with breast cancer in populations with diverse ancestry. Genome Med. [Internet] 2023;15(1):7. Disponible en: https://doi.org/10.1186/s13073-022-01152-5.
- Huang X, Lott PC, Hu D, Zavala VA, Jamal ZN, Vidaurre T, et al.; COLUMBUS Consortium; Fejerman L. Evaluation of Multiple Breast Cancer Polygenic Risk Score Panels in Women of Latin American Heritage. Cancer Epidemiol Biomarkers Prev. [Internet] 2025;34(2):234-245. Disponible en: https://doi.org/10.1158/1055-9965.EPI-24-1247.
- Arora K, Suehnholz SP, Zhang H, Ostrovnaya I, Kundra R, Nandakumar S, et al. Genetic Ancestry-Based Differences in Biomarker-Based Eligibility for Precision Oncology Therapies. JAMA Oncol. [Internet] 2025;11(3):310-316. Disponible en: https://doi.org/10.1001/jamaoncol.2024.5794.
- Filho AM, Laversanne M, Ferlay J, Colombet M, Piñeros M, Znaor A, et al. The GLOBOCAN 2022 cancer estimates: Data sources, methods, and a snapshot of the cancer burden worldwide. Int J Cancer. [Internet] 2025;156(7):1336-1346. Disponible en: https://doi.org/10.1002/ijc.35278.
- Ruíz-Patiño A, Rojas L, Zuluaga J, Arrieta O, Corrales L, Martín C, et al. Genomic ancestry and cancer among Latin Americans. Clin Transl Oncol. [Internet] 2024;26(8):1856-1871. Disponible en: https://doi.org/10.1007/s12094-024-03415-6.
- Spratt DE, Chan T, Waldron L, Speers C, Feng FY, Ogunwobi OO, et al. Racial/Ethnic Disparities in Genomic Sequencing. JAMA Oncol. [Internet] 2016;2(8):1070-4. Disponible en: https://doi.org/10.1001/jamaoncol.2016.1854.
- Luo M, Yang J, Schäffer AA, Chen C, Liu Y, Chen Y, et al. Ancestral Differences in Anticancer Treatment Efficacy and Their Underlying Genomic and Molecular Alterations. Cancer Discov. [Internet] 2025;15(3):511-529. Disponible en: https://doi.org/10.1158/2159-8290.CD-24-0827.
- Gaspar HA, Breen G. Probabilistic ancestry maps: a method to assess and visualize population substructures in genetics. BMC Bioinformatics. [Internet] 2019;20(1):116. Disponible en: https://doi.org/10.1186/s12859-019-2680-1.
- Alexander DH, Novembre J, Lange K. Fast model-based estimation of ancestry in unrelated individuals. Genome Res. [Internet] 2009;19(9):1655-64. Disponible en: https://doi.org/10.1101/gr.094052.109.
- Torres D, Lorenzo Bermejo J, Garcia Mesa K, Gilbert M, Briceño I, Pohl-Zeidler S, et al. Interaction between genetic ancestry and common breast cancer susceptibility variants in Colombian women. Int J Cancer. [Internet] 2019;144(9):2181-2191. Disponible en: https://doi.org/10.1002/ijc.32023.
- Zollner L, Torres D, Briceno I, Gilbert M, Torres-Mejía G, Dennis J, et al. Native American ancestry and breast cancer risk in Colombian and Mexican women: ruling out potential confounding through ancestry-informative markers. Breast Cancer Res. [Internet] 2023;25(1):111. Disponible en: https://doi.org/10.1186/s13058-023-01713-5.
- Hines LM, Sedjo RL, Byers T, John EM, Fejerman L, Stern MC, et al. The Interaction between Genetic Ancestry and Breast Cancer Risk Factors among Hispanic Women: The Breast Cancer Health Disparities Study. Cancer Epidemiol Biomarkers Prev. [Internet] 2017;26(5):692-701. Disponible en: https://doi.org/10.1158/1055-9965.EPI-16-0721.
- Herzog JS, Chavarri-Guerra Y, Castillo D, Abugattas J, Villarreal-Garza C, Sand S, et al. Genetic epidemiology of BRCA1- and BRCA2-associated cancer across Latin America. NPJ Breast Cancer. [Internet] 2021;7(1):107. Disponible en: https://doi.org/10.1038/s41523-021-00317-6.
- Nierenberg JL, Adamson AW, Hu D, Huntsman S, Patrick C, Li M, et al. Whole exome sequencing identifies FANCM as a susceptibility gene for estrogen-receptor-negative breast cancer in Hispanic/Latina women. Nat Commun. [Internet] 2025;16(1):7816. Disponible en: https://doi.org/10.1038/s41467-025-60564-0.
- Rey-Vargas L, Sanabria-Salas MC, Fejerman L, Serrano-Gómez SJ. Risk Factors for Triple-Negative Breast Cancer among Latina Women. Cancer Epidemiol Biomarkers Prev. [Internet] 2019;28(11):1771-1783. Disponible en: https://doi.org/10.1158/1055-9965.EPI-19-0035.
- Serrano-Gomez SJ, Sanabria-Salas MC, Fejerman L. Breast Cancer Health Disparities in Hispanics/Latinas. Curr Breast Cancer Rep. [Internet] 2020;12(3):175-184. Disponible en: https://doi.org/10.1007/s12609-020-00370-3.
- Romero-Cordoba SL, Salido-Guadarrama I, Rebollar-Vega R, Bautista-Piña V, Dominguez-Reyes C, Tenorio-Torres A, et al. Comprehensive omic characterization of breast cancer in Mexican-Hispanic women. Nat Commun. [Internet] 2021;12(1):2245. Disponible en: https://doi.org/10.1038/s41467-021-22478-5.
- Rey-Vargas L, Bejarano-Rivera LM, Mejia-Henao JC, Sua LF, Bastidas-Andrade JF, Ossa CA, et al. Association of genetic ancestry with HER2, GRB7 AND estrogen receptor expression among Colombian women with breast cancer. Front Oncol. [Internet] 2022;12:989761. Disponible en: https://doi.org/10.3389/fonc.2022.989761.
- Chande AT, Nagar SD, Rishishwar L, Mariño-Ramírez L, Medina-Rivas MA, Valderrama-Aguirre AE, et al. The Impact of Ethnicity and Genetic Ancestry on Disease Prevalence and Risk in Colombia. Front Genet. [Internet] 2021;12:690366. Disponible en: https://doi.org/10.3389/fgene.2021.690366.
- Zabaleta J, Serrano-Gómez SJ, Fejerman L, Muñoz-Antonia T, Cress D, Meade C, et al. Breast Cancer Precision Medicine in Hispanics/Latinas: Focus on Luminal B Tumors. En: Ramirez AG, Trapido EJ. (eds). Advancing the Science of Cancer in Latinos, Springer, Cham. [Internet]. 2020. Chapter 13. Disponible en: https://doi.org/10.1007/978-3-030-29286-7_13
- Hill DA, Prossnitz ER, Royce M, Nibbe A. Temporal trends in breast cancer survival by race and ethnicity: A population-based cohort study. PLoS One. [Internet] 2019;14(10):e0224064. Disponible en: https://doi.org/10.1371/journal.pone.0224064.
- Schmit SL, Purrington K, Figueiredo JC. Efforts to Grow Genomic Research in Ancestrally Diverse and Admixed Populations. Cancer Res. [Internet] 2023;83(15):2443-2444. Disponible en: https://doi.org/10.1158/0008-5472.CAN-23-1050.
- Raez LE, Cardona AF, Arrieta O, Lopes G. Lung Cancer Disparities in Hispanics: Molecular Diagnosis and Use of Immunotherapy. JCO Glob Oncol. [Internet] 2020;6:784-788. Disponible en: https://doi.org/10.1200/GO.20.00004.
- Wang SC, Yeu Y, Hammer STG, Xiao S, Zhu M, Hong C, et al. Hispanic/Latino Patients with Gastric Adenocarcinoma Have Distinct Molecular Profiles Including a High Rate of Germline CDH1 Variants. Cancer Res. [Internet] 2020;80(11):2114-2124. Disponible en: https://doi.org/10.1158/0008-5472.CAN-19-2918.
- Seagle HM, Keller SR, Tavtigian SV, Horton C, Holowatyj AN. Clinical Multigene Panel Testing Identifies Racial and Ethnic Differences in Germline Pathogenic Variants Among Patients With Early-Onset Colorectal Cancer. J Clin Oncol. [Internet] 2023;41(26):4279-4289. Disponible en: https://doi.org/10.1200/JCO.22.02378.
- Toal TW, Estrada-Florez AP, Polanco-Echeverry GM, Sahasrabudhe RM, Lott PC, Suarez-Olaya JJ, et al. Multiregional Sequencing Analysis Reveals Extensive Genetic Heterogeneity in Gastric Tumors from Latinos. Cancer Res Commun. [Internet] 2022;2(11):1487-1496. Disponible en: https://doi.org/10.1158/2767-9764.CRC-22-0149.
- Leitão LPC, de Carvalho DC, Rodrigues JCG, Fernandes MR, Wanderley AV, Vinagre LWMS, et al. Identification of Genomic Variants Associated with the Risk of Acute Lymphoblastic Leukemia in Native Americans from Brazilian Amazonia. J Pers Med. [Internet] 2022;12(6):856. Disponible en: https://doi.org/10.3390/jpm12060856.
- de Smith AJ, Jiménez-Morales S, Mejía-Aranguré JM. The genetic risk of acute lymphoblastic leukemia and its implications for children of Latin American origin. Front Oncol. [Internet] 2024;13:1299355. Disponible en: https://doi.org/10.3389/fonc.2023.1299355.
- Sisoudiya SD, Houle AA, Fernando T, Wilson TR, Schutzman JL, Lee J, et al. Ancestry-associated co-alteration landscape of KRAS and EGFR-altered non-squamous NSCLC. NPJ Precis Oncol. [Internet] 2024;8(1):153. Disponible en: https://doi.org/10.1038/s41698-024-00644-4.
- Yuan J, Hu Z, Mahal BA, Zhao SD, Kensler KH, Pi J, et al. Integrated Analysis of Genetic Ancestry and Genomic Alterations across Cancers. Cancer Cell. [Internet] 2018;34(4):549-560.e9. Disponible en: https://doi.org/10.1016/j.ccell.2018.08.019.
- Parra-Medina R, Castañeda-González JP, Montoya L, Paula Gómez-Gómez M, Clavijo Cabezas D, Plazas Vargas M. Prevalence of oncogenic driver mutations in Hispanics/Latin patients with lung cancer. A systematic review and meta-analysis. Lung Cancer. [Internet] 2023;185:107378. Disponible en: https://doi.org/10.1016/j.lungcan.2023.107378.

















